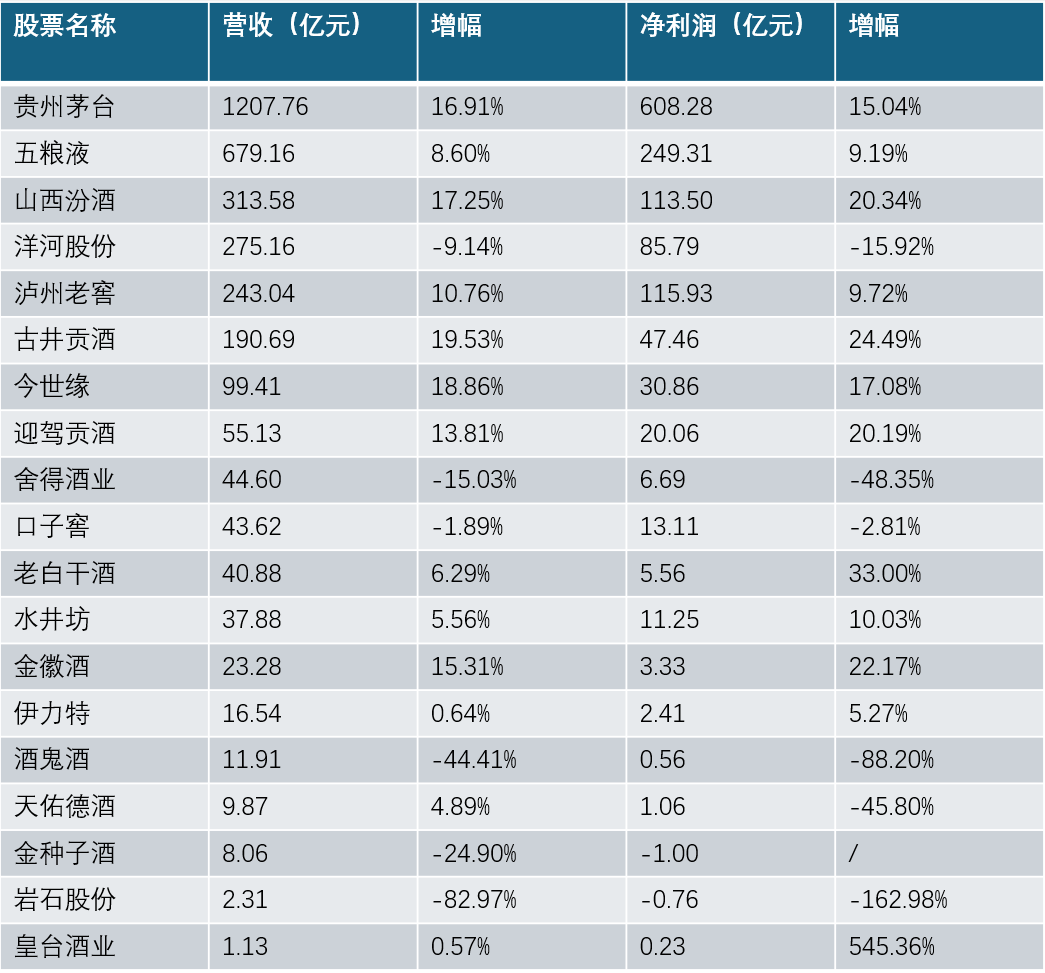
出口西班牙抗原试剂盒正在再次验证 国内没有销售
新冠疫情全球蔓延,多国出现病毒检测试剂盒短缺问题,中国不少体外诊断试剂企业进军海外市场。近日,西班牙多家媒体报道称,中国公司出口西班牙的抗原快速检测试剂质量不合格。
据西班牙《国家报》3月26日报道,深圳市易瑞生物技术股份有限公司(下称易瑞生物)的检测试剂只有30%的敏感度,远低于80%的预期。西班牙一名参与试剂质量分析的微生物学家称,“在这样的效果下,使用这些试剂盒进行检测是没有意义的”。
当地时间3月26日,中国驻西班牙大使馆通过社交媒体澄清,中国政府和商业机构捐赠给西班牙的物资中,并不包含易瑞生物的产品。大使馆还表示,中国商务部之前曾向西班牙提供符合资格认证的供应商名单,不包含易瑞生物。易瑞生物的检测产品并未获得中国国家药监局的官方销售许可。
同日,西班牙卫生、消费和社会福利部(下称西班牙卫生部)在官网发布信息称,政府是从西班牙国内一家供应商处购买了易瑞生物的试剂,这家供应商从中国进口了这些产品。西班牙卫生部还强调,这些产品均带有欧盟CE认证。产品只要获得这一认证便可在欧盟范围内销售。
易瑞生物向西班牙出口的是新冠抗原快速检测盒。3月27日,易瑞生物发布声明称,公司于3月12日取得新冠系列四个产品的欧盟CE认证。因未获得中国国家药监局注册证,相关新冠产品未在国内销售,仅供科研使用。
新批次产品正在验证
易瑞生物声明称,西班牙医院可能没有严格按照操作使用说明对鼻咽拭子进行采样、提取和操作,准确度下降或与此有关。易瑞生物认为,多种因素可能造成结果偏差,具体原因还在与西班牙方面沟通。
“公司此前编制了符合欧盟标准的外文说明材料,但西班牙方面具体是怎么操作使用的细节不是很清楚。”3月27日,易瑞生物相关负责人对财新记者说。易瑞生物介绍,西班牙卫生部决定更换公司新批次产品再次验证,预计未来1-2天会出验证报告。
财新记者当日走访易瑞生物深圳总公司了解到,春节假期后,该公司招募了100多名员工,其新冠抗原快速检测盒仍在继续生产。
针对公司产能及销售情况,上述负责人称,“公司在IPO静默期,不适宜过多披露信息”。
易瑞生物官网显示,公司成立于2007年7月,2016年启动上市工作。2019年6月28日,易瑞生物在证监会官网披露招股书,拟登陆深交所创业板。据招股书,朱海、王金玉夫妇为公司实际控制人。
官网显示,易瑞生物主营食品安全精准快速检测产品等相关服务,产品亦覆盖荧光PCR试剂盒和核酸提取试剂盒等。
财务数据显示,2016年至2018年,易瑞生物营收分别为8704.68万、1.38亿和2.05亿元,净利润分别为2342.03万、3926.54万和7391.28万元。
1月31日,深圳市科技创新委员会发布《深圳市抗击新冠肺炎疫情相关药品、医疗器械生产企业名单》,易瑞生物以其生产研发的干式荧光免疫分析仪成为89家入围企业之一。
抗原检测试剂未在国内获批
(300676.SZ)下属子公司总经理陈唯军告诉财新记者,“在感染新冠病毒早期,最合适的检测方法仍然是核酸检测。”陈唯军说,在感染出现症状的前四天,核酸检测阳性率可达93%。
陈唯军介绍,抗原检测法由于方法本身的局限性,灵敏度和核酸检测方法相比存在明显差距。据《国家报》报道,西班牙当地专家认为,应继续使用核酸检测手段,并已将这一信息报告给了卫生部下属的卡洛斯三世健康研究所。
“抗原检测试剂的检测效果并不理想,国家药监局没有批准任何一款针对新冠病毒的抗原检测试剂。国内放弃了这一技术路线,相关企业转而走向海外市场。”一名业内资深人士介绍称,不同地区对医疗器械的认证体系各不相同,欧盟CE认证属于“自证”体系,而中国药监局和美国FDA对医疗器械的认证则采取“他证”思路。
“在欧盟CE认证中,企业报批相关检测数据,并对披露信息承担责任。实际上,企业获得欧盟CE认证的难度并不高。”这名业内人士还称,中国国家药监局则会组织专门机构对产品进行多重检验,合格者才可获得注册证,产品才可上市销售。
3月27日,国家药监局在官网发布公告称,已应急批准23个新冠病毒检测产品,其中核酸检测试剂15个,抗体检测试剂8个。另据中国体外诊断网3月19日发布的消息,中国已有64家企业的新冠病毒检测产品进军欧盟。
3月27日上午,深圳市市场监督管理局在官方微博表态称,已就易瑞生物向西班牙出口新冠病毒检测试剂相关情况启动快速核查,具体情况将持续通报。据财新记者了解,该局当日前往易瑞生物深圳生产基地调查。
此文限时免费阅读。感谢热心读者订阅,支持新闻人一线探求真相!成为,畅读!
更多报道详见:
![<?=$public_r[sitename]?>](/skin/ecms074/images/logo.png)